Die molare Masse, auch als Molmasse oder Molgewicht bezeichnet, ist das Verhältnis der Masse m zur Stoffmenge n eines Stoffes. Sie ist eine intensive Größe, die angibt, wie viel Masse in einer bestimmten Menge einer Substanz enthalten ist.
Sie wird in kg/mol (im SI-System) oder g/mol (in der Chemie) gemessen. Die molare Masse einer chemischen Verbindung ergibt sich aus der Summe der Produkte der Molmasse der beteiligten chemischen Elemente, multipliziert mit ihren jeweiligen Stöchiometriefaktoren in der Summen- oder Verhältnisformel. Der Wert in g/mol entspricht der relativen Molekülmasse, die gleich dem Zahlenwert der Molekülmasse in atomaren Masseneinheiten (u oder Dalton) ist.
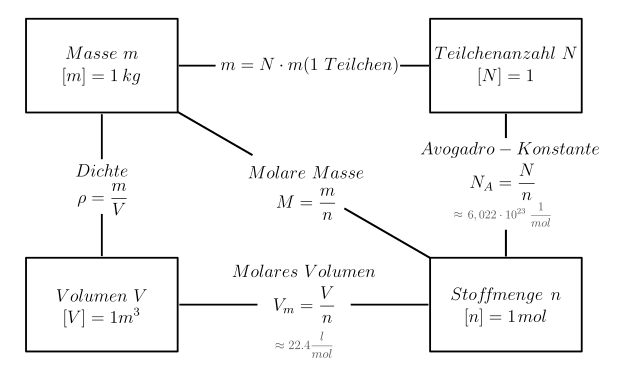
Die Größen Masse m, Stoffmenge n, Volumen V und Teilchenanzahl N sind miteinander verknüpft. Der angegebene Zahlenwert für das molare Volumen gilt näherungsweise für ideale Gase.
Molare Masse berechnen
Die Berechnung der molaren Masse einer Verbindung erfolgt durch die Kenntnis ihrer Summenformel. Man verwendet die Indexzahlen in der Summenformel, die hinter den Elementsymbolen stehen, und entnimmt die Molmasse jedes Elements aus Tabellen, wobei diese dem Zahlenwert der relativen Atommasse entspricht. Die Molmasse der Verbindung ergibt sich dann als die Summe der Produkte der molaren Massen der Elemente, multipliziert mit ihren Indexzahlen in der Summenformel.
Beispiel für Wasser (H2O):
Aus den molaren Massen der chemischen Elemente kann man die Molmasse aller Verbindungen berechnen.
| Element | Elementsymbol | Ordnungszahl | Molmasse |
|---|---|---|---|
| Wasserstoff | H | 1 | 1,00794 g/mol |
| Kohlenstoff | C | 6 | 12,0107 g/mol |
| Sauerstoff | O | 8 | 15,9994 g/mol |
| Verbindung | Summenformel | Zahl der Atome | Molare Masse |
|---|---|---|---|
| Wasserstoff | H2 | 2 | 2,01588 g/mol |
| Sauerstoff | O2 | 2 | 31,9988 g/mol |
| Wasser | H2O | 3 | 18,01528 g/mol |
| Methan | CH4 | 5 | 16,043 g/mol |
| Acetylsalicylsäure | C9H8O4 | 21 | 180,16 g/mol |
Erstmalige Bestimmung der molaren Masse
Das Avogadrosche Gesetz ermöglicht die erstmalige Bestimmung der Molmasse von Molekülen. Dieses besagt, dass bei gleicher Temperatur im Gaszustand gleich viele Moleküle einen nahezu identischen Rauminhalt einnehmen. Für einfache Moleküle wie Chlor, Wasserstoff, Chlorwasserstoff, Sauerstoff und Wasserdampf konnten die Verhältnisse durch Wägungen der Gase nach Elektrolyse ermittelt werden. Das Verfahren nach Bunsen ermöglicht die Bestimmung der molaren Massen von Gasen basierend auf den Ausströmungszeiten. Auch bei komplexeren organischen Molekülen kommt das Avogadrosche Gesetz zum Einsatz. Reine organische Stoffe werden verdampft und das verdrängte Wasservolumen wird gemessen.
Weitere Verfahren zur Bestimmung der molaren Masse umfassen:
- die Messung der Siedepunktserhöhung (Ebullioskopie)
- das Dumas-Verfahren, bei dem Stoffe verdampft wurden
- die Anwendung der Gefrierpunktserniedrigung (Kryoskopie)
- die Anwendung des osmotischen Drucks von Lösungen (Osmometrie) für nicht verdampfbare Moleküle
Die erstmalige Bestimmung basierte auf der Messung von Effekten, die ausschließlich von der Anzahl der beteiligten Teilchen und nicht von deren Masse abhängig sind (kolligative Effekte).
Bestimmung heutzutage
Die Massenspektrometrie ist ein präzises und empfindliches Messverfahren zur Bestimmung der relativen molaren Masse. Dies geschieht durch die Analyse des Molekülpeaks, wobei eine Kalibrierung mithilfe einer Standardsubstanz bekannter Molmasse erfolgt. In der hochauflösenden Massenspektrometrie ist es möglich, die molare Masse mit einer Genauigkeit von vier Nachkommastellen zu bestimmen und sogar die Summenformel zu ermitteln. Es ist jedoch zu beachten, dass die molare Masse eines Moleküls aufgrund seiner Isotopenzusammensetzung leicht variieren kann.
Ein weniger aufwändiges Verfahren zur Bestimmung der molaren Masse ist die elektrophoretische Methode, die jedoch nur eine grobe Schätzung ermöglicht. Dieses Verfahren spielt eine wichtige Rolle bei der Präparation von Proteinen, Restriktionsanalysen und anderen präparativen Verfahren.
Dieser Eintrag basiert auf dem Artikel Molare Masse aus der freien Enzyklopädie Wikipedia. Es gilt die GNU-Lizenz für freie Dokumentation. Eine Liste der Autoren ist auf Wikipedia verfügbar.
