Um sich vor Immunsystemen zu tarnen, nutzen viele Krankheitserreger bestimmte Zuckerverbindungen ihrer Opfer. Wissenschafter der Universität Bonn konnten in Kooperation mit Forschen der University of York in Großbritannien ein bakterielles Molekül analysieren, das an diesem Prozess beteiligt ist. Dabei konnten sie aufzeigen, dass sich das Protein mit einer Pac-Man-ähnlichen Kaubewegung in die Zuckermoleküle verbeißt. Die Ergebnisse könnten Anhaltspunkte für die Entwicklung neuer Medikamente geben. Die Studie ist nun im „Biophysical Journal“ erschienen.
Zellen der Mund-, Nasen- oder Darmschleimhaut produzieren in großen Mengen Sialinsäure.
Viele Bakterien verfügen über ein spezielles Transportsystem, mit dem sie die Zuckerverbindung aufnehmen können. So nutzen sie Sialinsäure zum Beispiel zur Energiegewinnung, aber auch, um dem aufmerksamen Immunsystem zu entgehen. Dazu erstellen sie eine Tarnkappe, indem sie Zucker in ihre Zellwand einbauen. Durch diese Verwendung körpereigener Substanzen erkennen Abwehrzellen nicht, dass es sich bei den Bakterien um Eindringlinge handelt.
Sialinsäure zur Energiegewinnung
Viele Bakterien sind von zwei Membranen umgeben, die sie wie dünne Häutchen umhüllen.
Oft wird Sialinsäure über den sogenannten TRAP-Transporter durch die innere dieser Membranen aufgenommen. Die P-Domäne – eine der drei Komponenten des TRAP-Transporters – patrouilliert frei beweglich zwischen den beiden Membranen. Wenn sie auf ein Sialinsäure-Molekül trifft, greift sie danach und bringt es zur inneren Membran, wo die beiden anderen Komponenten fest verankert sitzen.
Sie übernehmen die Aufgabe, die Zuckerverbindung in die Bakterienzelle zu schleusen.
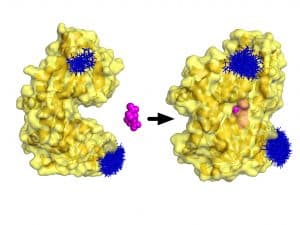
Dr. Gregor Hagelüken vom Institut für Physikalische und Theoretische Chemie der Universität Bonn erklärt: „Die atomare Struktur der P-Domäne war bereits bekannt. Nun wollten wir zusammen mit unserem Partner Dr. Gavin Thomas von der University of York herausfinden, wie genau sich die P-Domäne die Sialinsäure greift. Wir konnten zeigen, dass sie – bildlich gesprochen – mit geöffnetem Mund lauert, bis sie auf ein Zuckermolekül trifft. In diesem Moment schnappt sie zu.“
Diese rasante Kaubewegung der P-Domäne erinnert entfernt an die Computerspielfigur Pac-Man.
Um die Bewegungen des „Pac-Man-Kiefers“ nachzuvollziehen, nutzten die Forscher in ihrer Arbeit die EPR-Spektroskopie – eine Methode, mit der sich Abstände von Molekülteilen zueinander auf den zehnmillionstel Millimeter genau messen lassen.
„Dazu pflanzten wir den Bauplan für die P-Domäne in harmlose Darmbakterien ein und züchteten diese im Reagenzglas an“, erklärt Janin Glänzer, Doktorandin am Institut für Physikalische und Theoretische Chemie. „Dann haben wir das Protein in einem aufwendigen Verfahren gereinigt und fügten ihm unterschiedliche Mengen von Sialinsäure zu.“
Um die Kaubewegung zu untersuchen, wendeten die Forscher einen Trick an: Sie versahen die „Kiefer“ der P-Domäne mit molekularen Etiketten und konnten so den exakten Abstand zwischen diesen Markierungen messen.
„Wir konnten so einerseits zeigen, dass die P-Domäne nur in zwei Formen vorliegen kann: einer geöffneten und einer geschlossenen“, sagt der Chemiker Martin Peter, der in seiner Masterarbeit an dem Thema gearbeitet hat. „Eine stabile Übergangsform konnten wir nicht nachweisen. Ohne Sialinsäure befinden sich alle P-Domänen im geöffneten Zustand. Je mehr Zucker wir zugaben, desto mehr P-Domänen waren geschlossen.“
Hagelüken hofft, dass die Erkenntnisse möglicherweise dabei helfen, neue Wirkstoffe gegen Krankheitserreger zu entwickeln: „Wir können zum Beispiel versuchen, die Kaubewegung zu unterbinden – zum Beispiel durch einen molekularen Maulkorb oder eine Maulsperre.“
[alert-warning]Publikation
J. Glaenzer, M. Peter, G. H. Thomas, G. Hagelueken.
PELDOR Spectroscopy Reveals Two Defined States of a Sialic Acid TRAP Transporter SBP in Solution.
DOI: 10.1016/j.bpj.2016.12.010
Biophysical Journal, 2017.
Kontakt
Dr. Gregor Hagelüken
Institut für Physikalische und
Theoretische Chemie
Universität Bonn
[/alert-warning]