Die synthetische, großindustrielle Herstellung von Ammoniak (NH3) erfolgt durch das chemische Haber-Bosch-Verfahren. Benannt ist es nach den deutschen Chemikern Fritz Haber und Carl Bosch, die das Verfahren am Anfang des 20. Jahrhunderts entwickelten. Der zentrale Schritt des Verfahrens, die Ammoniaksynthese aus atmosphärischem Stickstoff und Wasserstoff, wird an einem eisenhaltigen Katalysator bei Drücken von etwa 150 bis 350 bar und Temperaturen von etwa 400 bis 500 °C durchgeführt.
Ammoniak ist eine chemische Substanz, die überwiegend für die Herstellung von Harnstoff, Ammoniumnitrat, Ammoniumsulfat sowie Ammoniumphosphaten genutzt wird. Diese Stoffe werden als Düngemittel verwendet und tragen zur Ernährung eines Großteils der Weltbevölkerung bei. Weiterhin dient Ammoniak der Herstellung von Sprengstoffen und anderen stickstoffhaltigen Chemikalien. Die selektive katalytische Reduktion nutzt Ammoniak in der Rauchgasentstickung zur Umwandlung schädlicher Stickoxide in Stickstoff und Wasser. Ammoniak wird außerdem seit 1876 als umweltfreundliches und energieeffizientes Kältemittel eingesetzt.
Die wissenschaftlichen Leistungen zur Realisierung dieses Verfahrens waren zum einen die Untersuchung der zugrunde liegenden chemischen Reaktion durch Fritz Haber und Walther Nernst, zum anderen die systematische Suche nach geeigneten Katalysatoren durch Alwin Mittasch sowie die Klärung grundlegender verfahrenstechnischer Probleme für Hochdruckverfahren durch Carl Bosch. Im Zusammenhang mit dem Haber-Bosch-Verfahren vergab die Nobelstiftung 1918 den Nobelpreis für Chemie an Fritz Haber, 1931 an Carl Bosch sowie 2007 an Gerhard Ertl, der die vollständige theoretische Erklärung des Mechanismus der Ammoniakbildung fand.
Geschichte
Im Jahr 1904 begann Fritz Haber sich mit den chemischen Grundlagen der Ammoniaksynthese zu beschäftigen. Die dabei gefundene Gleichgewichtskonstante für die Synthese von Ammoniak aus den Elementen Stickstoff und Wasserstoff entsprach bei einer Temperatur von 1000 °C und Normaldruck einer Ausbeute von unter 0,01 Prozent und war damit zu niedrig zur Realisierung eines technischen Prozesses. Haber war bewusst, dass ein höherer Druck zu besseren Ausbeuten führen würde, doch aufgrund der zu erwartenden technischen Probleme stellte er seine Forschungen auf diesem Gebiet vorübergehend ein. Erst eine wissenschaftliche Auseinandersetzung mit Walther Nernst über die Gleichgewichtskonstante der Ammoniaksynthese auf Grundlage des Nernst-Theorems veranlasste Haber, seine Arbeit fortzusetzen. Als Ergebnis weiterer Forschungen hielt er die Überführung in die Technik erst bei Temperaturen von unter 300 °C und nur mit einem geeigneten Katalysator für möglich. Die praktische Umsetzung gelang ihm kurz darauf mit Hilfe eines auf Osmium basierenden Katalysators.
Haber beantragte am 13. Oktober 1908 beim Kaiserlichen Patentamt in Berlin Patentschutz für ein „Verfahren zur synthetischen Darstellung von Ammoniak aus den Elementen“, den dieses am 8. Juni 1911 mit dem Patent Nr. 235.421 gewährte. Da er mittlerweile mit der BASF zusammenarbeitete, überließ er dem Unternehmen das Patent zur wirtschaftlichen Nutzung.
Die Bereitstellung vor allem des Rohstoffs Wasserstoff, der in größeren Mengen bis dahin nur bei der Chloralkali-Elektrolyse anfiel, erforderte völlig neue Prozesse. Auch für den Bau der zur Ammoniaksynthese benötigten chemischen Reaktoren, in denen Wasserstoff bei hohen Drücken und Temperaturen kontrolliert werden konnte, gab es bis dahin keine Referenzen in der Technik. Carl Bosch und Fritz Haber entwickelten daraufhin neue Lösungen in vielen Bereichen der technischen Chemie und des Reaktorbaus.
Aufgrund der großen Anzahl an benötigten Spezialisten zur Umsetzung der Herstellung im industriellen Maßstab gründete Bosch einen interdisziplinären Arbeitsbereich Chemietechnik, in dem Maschinenbauingenieure und Chemiker zusammen arbeiteten. Da die zunächst für den Reaktorbau verwendeten Stähle durch atomar eindiffundierten Wasserstoff erodierten, war eine Aufgabe des neuen Arbeitsbereiches die Erforschung von Werkstoffschäden durch Entkohlung der Kohlenstoffstähle. Dies führte schließlich zur Entwicklung hochlegierter Chrom-Nickel-Stähle, die einem Wasserstoffangriff bei den benötigten Reaktionstemperaturen und -drücken standhielten. Insbesondere das von Julius Schierenbeck entwickelte Schierenbeck-Wickelverfahren, bei dem auf ein chemisch widerstandsfähiges Zentralrohr mehrere Lagen eines heißen Metallbandes aufgeschrumpft wurden, ermöglichte den Bau größerer und sicherer Hochdruckreaktoren. Alwin Mittasch entwickelte und testete parallel dazu in 20.000 Versuchen etwa 3000 verschiedene Katalysatoren auf Basis von Eisenoxid mit verschiedenen umsetzungsbeschleunigenden Substanzen, die er Aktivator oder Promotor nannte. Der im Jahr 2015 verwendete Katalysator entsprach noch weitgehend dem von Mittasch entwickelten.
Im Jahr 1913 nahm die BASF erstmals eine Anlage nach dem Haber-Bosch-Verfahren im Werk Ludwigshafen-Oppau in Betrieb. Die Kapazität der Anlage betrug anfangs 30 Tonnen pro Tag. Bereits 1914 wurde die Weiterentwicklung des Verfahrens bis zur großindustriellen Anwendbarkeit durch den deutschen Generalstabschef Erich von Falkenhayn forciert, woraufhin Bosch das sogenannte Salpeterversprechen abgab. Dabei handelte es sich um einen Vertrag zur Lieferung von Nitraten mit staatlichen Abnahmegarantien und unter finanzieller Unterstützung durch das Reich für den Bau entsprechender Anlagen. Damit sollte Ammoniumnitrat als Grundlage militärischer Sprengstoffe in ausreichendem Maße ohne den sonst verwendeten natürlich vorkommenden Salpeter produziert werden können. Kurz darauf gelang es durch das Haber-Bosch-Verfahren, entsprechend große Mengen des kriegswichtigen Materials herzustellen. Damit konnte das durch die britische Seeblockade von Stickstoffquellen wie Chilesalpeter abgeschnittene Deutsche Reich im Ersten Weltkrieg seine Munitions- und auch seine Düngemittelproduktion aufrechterhalten und den wirtschaftlichen Zusammenbruch abwenden. Neben der Großanlage in Oppau bei Ludwigshafen wurden weitere in Leuna und Bitterfeld durch die BASF und nach Fusion im deutschen Großkonzern durch die I.G. Farben betrieben.
Nach dem Ersten Weltkrieg verpflichtete die Siegermacht Frankreich die BASF durch ein Abkommen, sämtliche Patente und Erfahrungen des Verfahrens herauszugeben und den Aufbau einer entsprechenden Fabrik in Toulouse zu unterstützen. Weitere Ammoniakanlagen entstanden zur selben Zeit in England, Italien und anderen Ländern. Diesen Bauvorhaben lag entweder eine Lizenz der BASF oder eine Verfahrensvariante mit veränderten Prozessparametern zugrunde, wozu das Casale-Verfahren und das Mont-Cenis-Uhde-Verfahren von dem 1921 gegründeten Ingenieurbüro Friedrich Uhde mit modifiziertem Katalysator zu zählen sind.
Durch die mit dem New Yorker Börsencrash vom Oktober 1929 beginnende Weltwirtschaftskrise verringerte sich die Nachfrage nach synthetischem Ammoniak erheblich. Die Produktion in Deutschland, die bereits ein Jahresvolumen von über 800.000 Tonnen erreicht hatte, sank daraufhin auf unter 500.000 Tonnen und die Einnahmen der I.G. Farben halbierten sich. Dennoch blieb die I.G. Farben bis 1930 der weltweit größte Hersteller von Ammoniak; 65 Prozent des Gesamtgewinns entfielen auf die Ammoniaksynthese.
Das vom Kabinett Brüning erlassene Einfuhrembargo für Stickstoffdünger erlaubte der I.G. Farben, die Preise für synthetische Düngemittel wieder zu erhöhen. Nach der Machtergreifung Hitlers übernahm das Nazi-Regime die Kontrolle über die I.G. Farben. Bosch stellte auf Druck des NS-Regimes 1935 seinen Vorstandsposten zur Verfügung, der an das NSDAP-Mitglied und Wehrwirtschaftsführer Hermann Schmitz fiel. 1940 erreichte die Ammoniakproduktion in Deutschland bereits eine Million Tonnen pro Jahr. Infolge des stetig steigenden Bedarfs an Ammoniak und seinen Folgeprodukten entstanden immer leistungsfähigere Reaktoren.
Die zunehmende Verfügbarkeit von preiswertem Erdöl und kostenreduzierenden Vergasungsprozessen durch beispielsweise die partielle Oxidation von Erdölfraktionen ermöglichte nach dem Zweiten Weltkrieg den Aufbau von Haber-Bosch-Anlagen in aller Welt. Die ursprünglich von der I.G. Farben entwickelte partielle Oxidation wurde durch das Unternehmen Imperial Chemical Industries (ICI) verbessert und um die Oxidation von Naphtha erweitert, womit in den 1950er und 1960er Jahren die Rohstoffe des Verfahrens preiswerter wurden.
Ingenieurunternehmen wie M. W. Kellogg entwickelten in der Folgezeit energieeffizientere und damit kostengünstigere Großanlagen mit nur einem Reaktor, die zu einer weltweiten Erhöhung der Anlagenkapazität führten. Zunehmender Wettbewerb und ein hoher Kostendruck ebneten schließlich den Weg für das LCA-Verfahren der ICI und das KAAP-Verfahren von Kellogg, Brown & Root, bei dem erstmals ein Rutheniumkatalysator Verwendung fand.
Rohstoffe
Ammoniak entsteht in einer Gleichgewichtsreaktion aus den Elementen Wasserstoff und Stickstoff gemäß der Gleichung:

wobei der benötigte Stickstoff der Umgebungsluft entnommen wird. Der ebenfalls in der Luft enthaltene, aber unerwünschte Sauerstoff wurde zunächst durch Reduktion mit Wasserstoff in Wasser umgesetzt und so abgeschieden; das Fauser-Verfahren nutzte den bei der Ammoniakverbrennung mit Luft nicht umgesetzten Stickstoff als Rohstoff. Später erwies sich die Stickstoffgewinnung durch Luftzerlegung nach dem Linde-Verfahren als wirtschaftlicher.
Den größten Teil der Produktionskosten verursacht die Beschaffung von Wasserstoff, der zunächst aus der kostenintensiven Chloralkali-Elektrolyse gewonnen wurde. Mit Erdgas, Erdöl, Kohle sowie den Elektrolyseprodukten von Wasser kamen später weitere Quellen zur Erzeugung von Wasserstoff hinzu.
Die BASF verwendete Wassergas auf Basis der Kohlevergasung von Braunkohle mittels eines Winkler-Generators als primäre Quelle. Der Wasserstoff wird dabei über die Reaktion von Wasserdampf mit glühendem Koks gewonnen. Die zugeführte Luft wird derart dosiert, dass der Sauerstoff vollständig zu Kohlenstoffmonoxid umgesetzt wird. Der für die spätere Ammoniaksynthese erforderliche Stickstoff verblieb im Wassergas. Anschließend wurde das Kohlenstoffmonoxid mittels Konvertierung in leicht zu entfernendes Kohlenstoffdioxid oder in einer Wassergas-Shift-Reaktion zur Bereitstellung weiteren Wasserstoffs verwendet. Mit dem Rohstoff Kohle wurden im Jahr 2008 etwa 18 Prozent des weltweit produzierten Wasserstoffs hergestellt.
Obwohl Erdgas in den 1920er Jahren der BASF noch nicht als Rohstoff für die Herstellung von Wasserstoff zur Verfügung stand, initiierte Carl Bosch bereits die Entwicklung der Dampfreformierung von Methan, welche später ein wichtiger Bestandteil des Verfahrens werden sollte. Einen Durchbruch erzielte Georg Schiller für die I.G. Farben, dem die Dampfreformierung von Methan mittels eines Nickeloxid-Katalysators gelang. Der Standard Oil of New Jersey wurde eine Lizenz erteilt, die 1931 mit der Wasserstoffproduktion durch Dampfreformierung in ihrem Werk in Baton Rouge in Louisiana begann. Auf die Dampfreformierung von Erdgas entfielen 2014 etwa 48 Prozent der globalen Wasserstoffproduktion, zirka 60 Prozent davon verwendete das Haber-Bosch-Verfahren.
Ein anderes mögliches Verfahren der Wasserstoffgewinnung ist die partielle Oxidation. Dabei werden erdgas- oder erdölstämmige Kohlenwasserstoffe mit Sauerstoff und Wasserdampf in einem offenen Reaktor ohne Katalysator bei etwa 1100 °C vergast und das Synthesegas wie bei der Dampfreformierung weiterverarbeitet. Die höheren Kohlenwasserstoffe aus Erdöl trugen 2008 zu 30 Prozent zur jährlichen Produktion von Wasserstoff bei.
Wasserstoff kann weiterhin durch die Elektrolyse von Wasser gewonnen werden. Hierdurch wird mit elektrischer Energie Wasser in Wasserstoff (H2) und Sauerstoff (O2) zerlegt. Dieses Verfahren ist nur wirtschaftlich, wenn preiswerte elektrische Energie zum Beispiel aus Wasserkraft zur Verfügung steht. Auf die Elektrolyse entfielen 2008 etwa vier Prozent der Wasserstoffproduktion. Angesichts der Klimaproblematik und dem Bestreben, CO2-Emissionen zu verringern, ist diese Möglichkeit der Wasserstoffgewinnung unter Verwendung erneuerbarer Energien wie Windkraft oder Solarstrom wieder stark in den Fokus der Politik und Wirtschaft gelangt.
Mit dem Aufkommen von Platforming-Kapazitäten in den Vereinigten Staaten Mitte der 1950er Jahre stand eine petrochemische Wasserstoffquelle zur Verfügung, die 1956 etwa elf Prozent des benötigten Wasserstoffs für die Ammoniaksynthese in den Vereinigten Staaten bereitstellte. Später nutzten andere Raffinerieverfahren wie die Hydrodesulfurierung sowie das Hydrocracken den anfallenden Wasserstoff.
Katalysator
Zur Senkung der Aktivierungsenergie und der damit einhergehenden Steigerung der Reaktionsgeschwindigkeit wird bei vielen chemischen Prozessen ein zusätzlicher Stoff, der Katalysator, eingesetzt, der während der Reaktion nicht verbraucht wird. Unterscheidet sich dabei der Aggregatzustand des Katalysators von dem der eigentlichen miteinander reagierenden Stoffe, handelt es sich um einen heterogenen Katalysator. So auch beim Haber-Bosch-Verfahren, bei dem feinverteiltes Eisen auf einem Eisenoxidträger in fester Form als Katalysator innerhalb eines reagierenden Gasgemisches dient. Dieser heterogene Katalysator, auch „Kontakt“ genannt, entsteht während der Reaktion aus einem anderen, zuvor im Reaktor eingebrachten Material, dem „Katalysatorvorläufer“ oder „Präkursorkontakt“.
Reaktionstechnik
Synthesebedingungen
Die Ammoniaksynthese findet bei einem Mengenverhältnis Stickstoff zu Wasserstoff von 1 zu 3, einem Druck von 250 bis 350 bar, einer Temperatur von 450 bis 550 °C und unter Verwendung von α-Eisen als Katalysator gemäß folgender Gleichung statt:
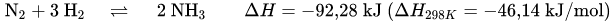
Die Reaktion ist eine exotherme, unter Volumenverminderung ablaufende Gleichgewichtsreaktion, deren Massenwirkungskonstante Keq sich aus folgender Gleichung ergibt:
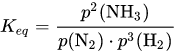
Da die Reaktion exotherm ist, verschiebt sich das Gleichgewicht der Reaktion bei niedrigeren Temperaturen auf die Seite des Ammoniaks. Weiterhin entstehen aus vier Volumenteilen der Rohmaterialien zwei Volumenteile von Ammoniak. Gemäß dem Prinzip vom kleinsten Zwang begünstigt ein hoher Druck daher ebenfalls die Entstehung von Ammoniak. Es ist zudem ein hoher Druck notwendig, um eine ausreichende Oberflächenbedeckung des Katalysators mit Stickstoff zu gewährleisten.
Der Katalysator Ferrit (α-Fe) entsteht im Reaktor durch die Reduktion von Magnetit mit Wasserstoff. Dieser ist ab Temperaturen von etwa 400 bis 500 °C optimal wirksam. Durch den Katalysator wird die Aktivierungsbarriere für die Spaltung der Dreifachbindung des Stickstoffmoleküls stark abgesenkt, dennoch sind hohe Temperaturen für eine angemessene Reaktionsgeschwindigkeit erforderlich. Bei der gewählten Reaktionstemperatur liegt das Optimum zwischen dem Zerfall von Ammoniak in die Ausgangsstoffe und der Wirksamkeit des Katalysators. Das gebildete Ammoniak wird laufend aus dem Reaktionssystem entfernt. Der Volumenanteil von Ammoniak im Gasgemisch beträgt rund 20 %.
Die inerten Bestandteile, besonders die Edelgase wie Argon, dürfen einen bestimmten Gehalt nicht überschreiten, um den Partialdruck der Reaktanden nicht zu sehr abzusenken. Zur Entfernung der inerten Gasbestandteile wird ein Teil des Gases abgezogen und das Argon in einer Gastrennanlage abgeschieden. Die Gewinnung reinen Argons aus dem Kreislaufgas ist mittels Linde-Verfahren möglich.
Großtechnische Durchführung
Moderne Ammoniakanlagen erzeugen mehr als 3000 Tonnen pro Tag in einer Produktionslinie. Das folgende Schema zeigt den Aufbau einer Haber-Bosch-Anlage.
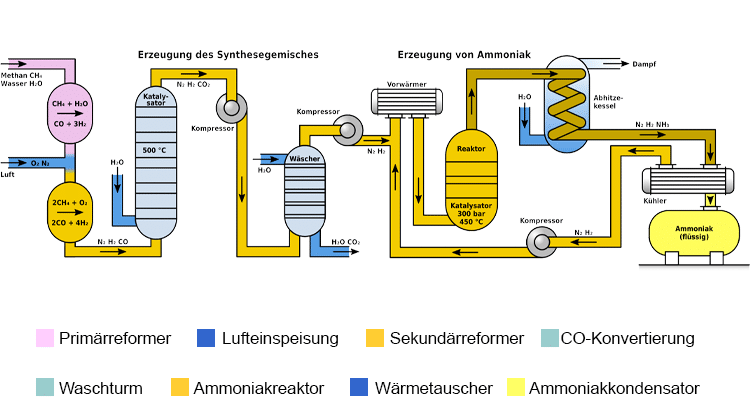
Je nach Herkunft des Synthesegases muss dieses zunächst von Verunreinigungen wie Schwefelwasserstoff oder organischen Schwefelverbindungen befreit werden, die als Katalysatorgift wirken. Hohe Konzentrationen von Schwefelwasserstoff, die bei Synthesegas aus Schwelkoksen vorkommen, werden in einer Nassreinigungsstufe wie dem Sulfosolvan-Verfahren entfernt, niedrige Konzentrationen durch Adsorption an Aktivkohle. Organoschwefelverbindungen werden mittels Druckwechseladsorption zusammen mit Kohlenstoffdioxid nach der CO-Konvertierung abgeschieden.
Zur Herstellung von Wasserstoff mittels Dampfreformierung reagiert Methan mit Wasserdampf mit Hilfe eines Nickeloxid-Aluminiumoxid-Katalysators im Primärreformer zu Kohlenstoffmonoxid und Wasserstoff. Die dafür benötigte Energie, die Enthalpie ΔH, beträgt dabei 206 kJ/mol.
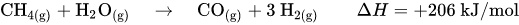
m Primärreformer setzt sich das Methangas nur unvollkommen um. Um die Ausbeute an Wasserstoff zu erhöhen und den Gehalt an inerten Bestandteilen so gering wie möglich zu halten, wird in einem zweiten Schritt im Sekundärreformer das restliche Methangas mit Sauerstoff zu Kohlenstoffmonoxid und Wasserstoff umgesetzt. Der Sekundärreformer wird hierzu mit Luft beschickt, wobei auch der für die spätere Ammoniaksynthese erforderliche Stickstoff in das Gasgemisch kommt.
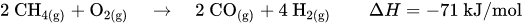
In einem dritten Schritt wird das Kohlenstoffmonoxid zu Kohlenstoffdioxid oxidiert, was als CO-Konvertierung oder Wassergas-Shift-Reaktion bezeichnet wird.
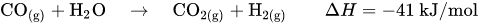
Kohlenstoffmonoxid und Kohlenstoffdioxid bilden mit Ammoniak Carbamate, die als Feststoffe in kurzer Zeit Rohrleitungen und Apparate verstopfen würden. Im folgenden Prozessschritt muss daher das Kohlenstoffdioxid aus dem Gasgemisch entfernt werden. Im Gegensatz zu Kohlenstoffmonoxid kann Kohlenstoffdioxid durch eine Gaswäsche mit Triethanolamin leicht aus dem Gasgemisch entfernt werden. Das Gasgemisch enthält dann noch Edelgase wie Argon sowie Methan, die sich inert verhalten.
Anschließend wird das Gasgemisch mittels Turbokompressoren auf den benötigten Betriebsdruck komprimiert. Die entstehende Verdichtungswärme wird mittels Wärmetauschern abgeführt; sie wird zur Vorheizung von Rohgasen eingesetzt.
Im Ammoniakreaktor findet die eigentliche Herstellung von Ammoniak statt, wobei die ersten Reaktoren unter dem hohen Druck platzten, da der atomare Wasserstoff im kohlenstoffhaltigen Stahl zu Methan teilrekombinierte und Risse im Stahl erzeugte. Deshalb entwickelte Bosch Rohrreaktoren, bestehend aus einem drucktragenden Stahlrohr, in dem ein Futterrohr aus kohlenstoffarmem Eisen einzogen wurde, in welches der Katalysator eingefüllt wurde. Durch das innere Stahlrohr diffundierender Wasserstoff entwich nach außen über dünne Bohrungen des äußeren Stahlmantels, den sogenannten Bosch-Löchern. Die Entwicklung wasserstoffbeständiger Chrom-Molybdän-Stähle erlaubte die Konstruktion einwandiger Rohre. Ein Nachteil der Rohrreaktoren war der relativ hohe Druckverlust, der durch Kompression wieder aufgebracht werden musste.
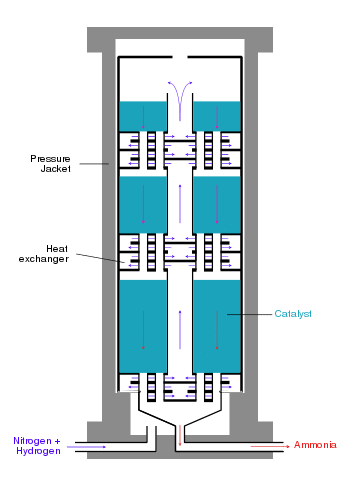
Moderne Ammoniak-Reaktoren sind als Etagenreaktoren mit geringem Druckverlust ausgeführt, bei denen die Kontakte als Schüttungen auf etwa zehn übereinander befindlichen Etagen verteilt sind. Sie werden von oben nach unten nacheinander vom Gasgemisch durchströmt. Zur Kühlung wird seitlich Kaltgas eingedüst. Ein Nachteil dieses Reaktortyps ist die unvollständige Umsetzung des Kaltgasgemischs im letzten Katalysatorbett.
Alternativ wird zwischen den Katalysatorschichten das Reaktionsgemisch mittels Wärmetauschern gekühlt, wobei das Wasserstoff-Stickstoff-Gemisch auf Reaktionstemperatur vorgeheizt wird. Reaktoren dieses Typs weisen drei Katalysatorbetten auf. Neben einer guten Temperaturkontrolle besteht bei diesem Reaktortyp der Vorteil einer besseren Umsetzung der Rohstoffgase gegenüber Reaktoren mit Kaltgaseinspeisung. Im Uhde-Reaktor werden die Katalysatorbetten sogar radial durchströmt, was den Druckverlust des Reaktors weiter verringert.
Das Reaktionsprodukt wird für eine maximale Ausbeute laufend entfernt. Dazu wird das Gasgemisch von 450 °C in einem Wärmetauscher mittels Wasser, frisch zugeführten Gasen und andere Prozessströme abgekühlt. Dabei kondensiert auch das Ammoniak und wird in einem Druckabscheider abgetrennt. Die noch nicht umgesetzten Reaktanten Stickstoff und Wasserstoff werden mittels eines Kreislaufgasverdichters wieder auf Reaktionsdruck verdichtet, mit Frischgas ergänzt und dem Reaktor zugeführt. In einer nachfolgenden Destillation wird der Ammoniak noch gereinigt.
Produkte
Der Großteil des jährlich benötigten Ammoniaks wird mit dem Haber-Bosch-Verfahren erzeugt. Die Jahresproduktion betrug 2017 etwa 150 Millionen Tonnen mit China, Indien und Russland als größten Produzenten. Aufgrund des hohen Energiebedarfs bei der Herstellung des benötigten reinen Wasserstoffs entfallen etwa 1,4 Prozent des Weltenergiebedarfs auf das Haber-Bosch-Verfahren. Die dabei erzeugten Kohlenstoffdioxidemissionen betragen etwa drei bis fünf Prozent des globalen Ausstoßes, wobei ein Teil zur Erzeugung von Harnstoff genutzt wird. Heutzutage haben, zumindest bei der Bevölkerung der Industrienationen, etwa 40 Prozent des im menschlichen Körper enthaltenen Stickstoffs schon einmal an der Haber-Bosch-Synthese teilgenommen.
Das Primärprodukt Ammoniak wird zu etwa 80 Prozent zu Dünger weiterverarbeitet, 20 Prozent entfallen auf andere Produkte. Die wichtigsten auf Ammoniak basierenden Stickstoffdünger sind neben den gasförmigen und wässrigen Lösungen von Ammoniak das Ammoniumnitrat und Harnstoff.
Die Produktion von Harnstoff in einem Hochdruckverfahren geht auf Carl Bosch und Wilhelm Meiser zurück und wurde 1922 von der BASF erstmals in Betrieb genommen. Im Jahr 2010 betrug das Produktionsvolumen 130 Millionen Tonnen. Die gesamte Weltproduktion von Salpetersäure erfolgt durch katalytische Verbrennung nach dem Ostwaldverfahren. Das Verfahren geht auf einen Vorlesungsversuch zurück, bei dem ein glühender Platindraht in ein Ammoniak-Luft-Gemisch getaucht wird, um nitrose Gase zu erzeugen. Die Weltjahresproduktion betrug 80 Millionen Tonnen im Jahr 2009. Das meistproduzierte Folgeprodukt der Salpetersäure ist Ammoniumnitrat; die Jahresproduktion betrug 2002 etwa 39 Millionen Tonnen, von denen etwa 80 Prozent zu Düngemitteln und 20 Prozent zu Sprengstoffen verarbeitet werden.Weitere Folgeprodukte wie Kaliumnitrat, partiell oder vollständig mit Ammoniak neutralisierte Phosphate wie Mono-, Di- und Ammoniumpolyphosphate, Ammoniumsulfat sowie Ammoniumnitrat-Harnstoff-Lösung sind häufig eingesetzte Dünger.
Etwa fünf Prozent der Ammoniakproduktion werden zur Herstellung von Sprengstoffen verwendet.Die in vielen Sprengstoffen vorkommenden Nitro- und Nitratgruppen basieren letztlich auf Ammoniak, das nach dem Haber-Bosch-Verfahren gewonnen wurde, darunter sind wichtige Sprengstoffe wie Trinitrotoluol und Nitroglycerin.Ungefähr zehn Prozent der Ammoniakproduktion wird für die Herstellung stickstoffhaltiger Verbindungen wie Nitrilen, Aminen und Amiden verwendet. Die Palette der Folgeprodukte ist äußerst vielfältig und reicht von Harnstoffharzen, Sulfonamiden über Nitrobenzol und dessen Folgeprodukt Anilin in die Polyurethan- und Farbstoffchemie, Caprolactam für die Produktion von Polymeren und bis hin zu Raketentreibstoffen wie Hydrazin.
Ein wichtiges Nebenprodukt des Verfahrens ist darüber hinaus die Kohlensäure, da das beim Haber-Bosch-Verfahren entstehende Kohlendioxid relativ rein anfällt und nicht aufwändig weiterverarbeitet werden muss. Das Kohlendioxid wird in Wasser gelöst als Kohlensäure in der Getränkeindustrie genutzt.
Dieser Eintrag basiert auf dem Artikel Haber-Bosch-Verfahren aus der freien Enzyklopädie Wikipedia. Es gilt die GNU-Lizenz für freie Dokumentation. Eine Liste der Autoren ist auf Wikipedia verfügbar.
[…] diente der Gewinnung von Salpetersäure. Diese Verfahren wurden bald darauf abgelöst durch das Haber-Bosch-Verfahren, nach Fritz Haber und Carl Bosch, zur Synthese von Ammoniak aus Luftstickstoff und Wasserstoff […]