Hydrolyse ist ein Prozess der Aufspaltung einer chemischen Verbindung durch Reaktion mit Wasser, wobei zwei neue Moleküle entstehen. Während sich ein Wasserstoffatom an das eine Spaltprodukt bindet, wird die übrige Hydroxygruppe an das andere gebunden.
Dieser Prozess ist besonders wichtig bei der Zersetzung von Biomolekülen wie Proteinen, Fetten und Polysacchariden. Hydrolyse spielt eine bedeutende Rolle in der Herstellung von Biokraftstoffen, da sie in der Lage ist, Biomasse in Glucose umzuwandeln. Sie wird unter anderem verwendet, um Glucose aus Lignocellulose für die Herstellung von Bioethanol zu gewinnen.
Allgemein gilt für die Hydrolyse einer Verbindung X-Y: Die Verbindung X–Y reagiert mit Wasser (H–OH; H2O) wodurch zwei neue Verbindungen (X–H und Y–OH) entstehen.
X-Y + H-OH -> X-H + Y-OH
Eine wichtige Hydrolyse-Reaktion, die Proteinen Energie für mechanische Arbeit und Transportprozesse liefert, ist die Spaltung von Adenosintriphosphat (ATP) zu Adenosindiphosphat (ADP) und einem Phosphatrest.
Hydrolysen verlaufen in sauren oder basischen Medien, im Vergleich zu neutralen pH-Werten, effizienter und schneller. Beispiele dafür sind die saure Hydrolyse von Estern, die die Umkehrreaktion zur Veresterung darstellt, sowie die alkalische Verseifung.
Beispiele für Hydrolyse
Carbonsäurechloride
Carbonsäurechloride sind wichtige Verbindungen in der Chemie und gehören zur Gruppe der Carbonsäurehalogenide. Sie leiten sich von Carbonsäuren ab, bei denen die Hydroxygruppe durch ein Chloratom ersetzt ist, wodurch eine Chlorcarbonylgruppe entsteht. Niedermolekulare Carbonylchloride reagieren mit Wasser in einer heftigen, stark exothermen Reaktion und bilden die entsprechende Carbonsäure und Chlorwasserstoff. Die Geschwindigkeit dieser Hydrolyse hängt von der Wasserlöslichkeit ab, wobei eine geringere Wasserlöslichkeit zu einer langsameren Reaktion führt.
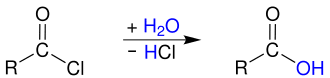
Calciumcarbid
Calciumcarbid gehört zur Gruppe der Carbide und zählt zu den Acetyliden, da es formal von Ethin abgeleitet ist. Es ist in keinem Lösungsmittel löslich. Beim Kontakt mit Wasser erfolgt eine lebhafte Hydrolyse, bei der Calciumcarbid in Ethin und Calciumhydroxid zerfällt. Der unangenehme „Carbid“-Geruch entsteht nicht durch das gebildete Ethin, sondern durch Gase wie Monophosphan, Ammoniak und Schwefelwasserstoff, die durch die Reaktion von Verunreinigungen mit Wasser entstehen. Monophosphan entsteht dabei durch die Hydrolyse von in Calciumcarbid enthaltenem Calciumphosphid (Ca3P2).
Carbonsäureanhydride
Carbonsäureanhydride sind reaktive organische Verbindungen, die sich von Carbonsäuren ableiten und aus zwei Acylgruppen bestehen, die durch ein Sauerstoffatom miteinander verbunden sind. Sie werden als reaktive Carbonsäurederivate betrachtet. Bei der Reaktion von Carbonsäureanhydriden mit Wasser entstehen zwei Moleküle der zugrunde liegenden Carbonsäure. Durch die Hydrolyse von Acetanhydrid entstehen zwei Äquivalente Essigsäure:

Isonitrile
Isonitrile, auch bekannt als Isocyanide nach IUPAC-Nomenklatur, sind organische Verbindungen mit der Struktur R-N≡C, wobei R ein kohlenstoffhaltiger Rest wie Alkyl- oder Arylgruppen ist. Sie sind reaktive, übelriechende und giftige Verbindungen, die isostere Ähnlichkeiten mit Kohlenstoffmonoxid aufweisen und daher gute Komplexliganden sind. Die Hydrolyse von Isonitrilen führt zur Bildung von Ameisensäure und primären Aminen.
Tetrachlorsilan
Tetrachlorsilan ist eine farblose, flüchtige, an feuchter Luft rauchende Flüssigkeit, die aus den Elementen Silicium und Chlor besteht. Sie ist äußerst reaktiv und reagiert heftig mit Wasser. Bei der Hydrolyse entstehen Zwischenprodukte wie SiCl3(OH), SiCl2(OH)2 und SiCl(OH)3, die bei niedrigeren Temperaturen isoliert werden können. Diese Zwischenprodukte können unter Wasserabspaltung zu linearen Verbindungen vom Typ SinO(n-1)Cl(2n+2) dimerisieren oder polymerisieren, wobei Chlorwasserstoff die Polymerisation beschleunigt.
Dieser Eintrag basiert auf dem Artikel Hydrolyse aus der freien Enzyklopädie Wikipedia. Es gilt die GNU-Lizenz für freie Dokumentation. Eine Liste der Autoren ist auf Wikipedia verfügbar.
[…] Wissenschaftler haben eine Klasse von zuckerbasierten Polymeren entwickelt, die sich durch saure Hydrolyse chemisch abbauen lassen. Die Forscher bauten auch „Fracht“-Moleküle zur späteren Abspaltung […]