Aus Kohlenstoffdioxid wichtige Ausgangsmaterialien für Feinchemikalien machen – das funktioniert tatsächlich: Einem Forscherteam des Fraunhofer IGB ist es im Max-Planck-Kooperationsprojekt eBioCO2n erstmals gelungen, CO2 in einer auf dem Transfer von Elektronen basierenden Enzymkaskade zu fixieren (CO₂-Fixierung) und in einen festen Ausgangsstoff für die chemische Industrie umzuwandeln.
Durch die Verbrennung von fossilen Rohstoffen entsteht klimaschädliches Kohlenstoffdioxid, das als Treibhausgas eine große Rolle bei der Erderwärmung spielt. Dennoch ist Erdöl aktuell immer noch einer der wichtigsten Rohstoffe – nicht nur als Energieträger, sondern auch als Ausgangsmaterial für die chemische Industrie und damit für zahlreiche Dinge unseres Alltags, wie Medikamente, Verpackungen, Textilien, Reinigungsmittel und mehr. An verschiedenen Alternativen für fossile Quellen wird daher intensiv geforscht.
Nachwachsende Rohstoffe sind eine zukunftsträchtige Möglichkeit, aber nicht die einzige alternative Rohstoffbasis, um die Verfügbarkeit von grünen Syntheseprodukten in den nächsten Jahren abdecken zu können. Eine nachhaltige Ergänzung hierzu im Sinne einer kreislauforientierten Kohlenstoffwirtschaft ist die Möglichkeit, CO2 gezielt und unter milden Reaktionsbedingungen zu fixieren.
Abscheidung aus der Luft für weniger CO2-Emissionen
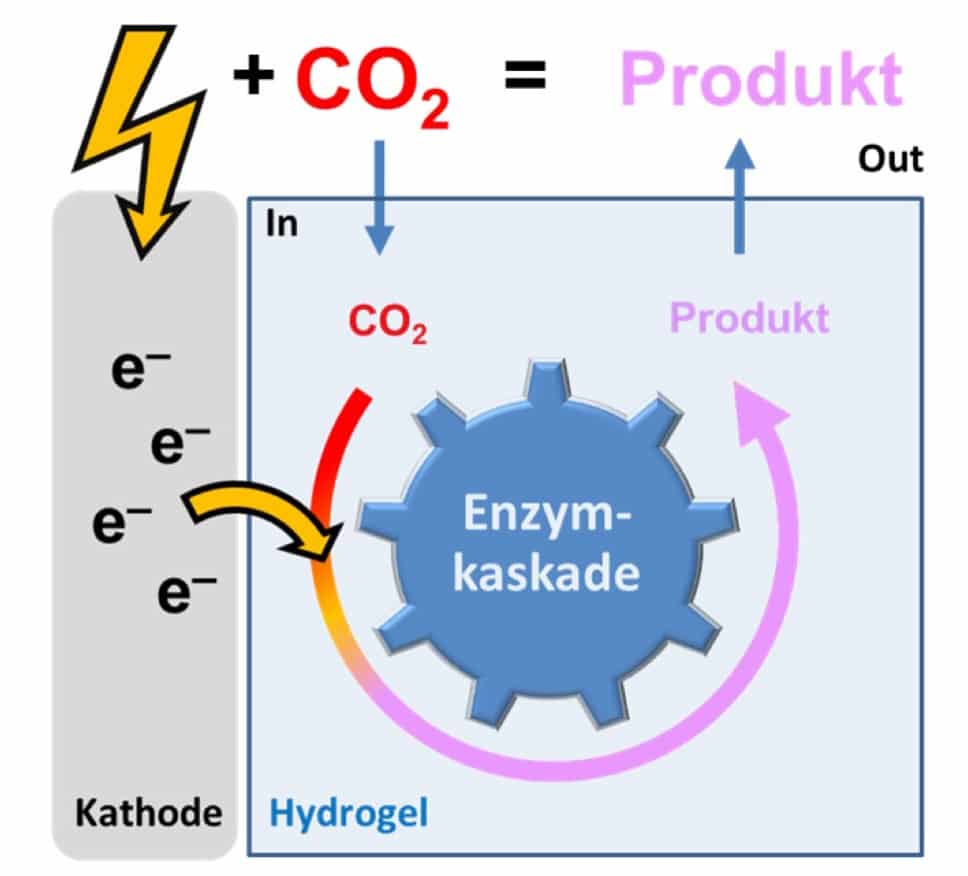
Einem Forscherteam am Straubinger Institutsteil des Fraunhofer-Instituts für Grenzflächen- und Bioverfahrenstechnik IGB ist es nun gemeinsam mit Kolleginnen und Kollegen des Max-Planck-Instituts für terrestrische Mikrobiologie in Marburg und der TU München erstmals gelungen, CO2 elektrobiokatalytisch in wertvolle Substanzen für die chemische Industrie umzuwandeln. Durch Kombination verschiedener Ansätze aus Bioelektrochemie, Enzymbiologie und synthetischer Biologie wurden hierfür spezielle Bioelektroden entwickelt, um mit Strom aus erneuerbarer Energie Enzyme anzutreiben, die in einer gekoppelten Reaktion ähnlich der Photosynthese feste organische Moleküle aus dem Treibhausgas herstellen.

Ziel ist es, damit CO2 direkt aus der Luft abzuscheiden: „Das Verfahren könnte dann nicht nur dazu beitragen, dass die Industrie auf fossile Rohstoffe verzichten kann, sondern durch die CO2-Reduktion die Klimawende außerdem aktiv vorantreiben“, erklärt Dr. Michael Richter, Leiter des Innovationsfelds Bioinspirierte Chemie am Fraunhofer IGB. „Zunächst ging es uns jedoch darum zu zeigen, dass unsere Idee überhaupt funktioniert, eine solch komplexe biokatalytische Multienzym-Reaktion auf diese Art mit Strom anzutreiben.“
Hydrogel transportiert Elektronen für CO2-fixierende Enzyme
Mit Erfolg: Die Forschenden haben sich vom Stoffwechsel der Mikroorganismen inspirieren lassen und ein strombasiertes Verfahren für die CO2-Fixierung entwickelt. Hauptakteure sind CO2 fixierende Enzyme, die von den Kollegen Dr. David Adam und Prof. Tobias Erb, Direktor am MPI in Marburg, entwickelt wurden. Eine Herausforderung bestand nun darin, die CO2-fixierenden Enzyme kontinuierlich mit den für die Reduktion von CO2 benötigten Elektronen zu versorgen, die regenerativer Strom liefern kann. Dies gelang durch Einbettung der Enzyme in ein redoxaktives Hydrogel, wodurch sie elektrochemisch so angetrieben werden können, dass sie Kohlenstoffdioxid an ein Substrat binden und damit in einen wertvollen Zwischenstoff umwandeln.
„Das Verfahren ist ein sehr effizienter Reaktionsweg, eine reduktive Carboxylierung, die sehr ökonomisch und sauber abläuft, weil man keine weiteren Substanzen im System braucht – lediglich Kohlenstoffdioxid, Substrat und Elektronen, bevorzugt aus erneuerbaren Quellen“, erläutert Dr. Leonardo Castañeda-Losada, der in seiner Doktorarbeit auf dem Gebiet der Elektrobiokatalyse forschte und nun am Fraunhofer IGB gemeinsam mit Dr. Melanie Iwanow und Dr. Steffen Roth im Projekt arbeitet.

Die an der TU München am Lehrstuhl von Prof. Nicolas Plumeré eigens entwickelten Hydrogele, in denen die Enzyme ihre Arbeit verrichten, sind so modifiziert, dass sie Elektronen gut leiten und den Biomolekülen gleichzeitig optimale Arbeitsbedingungen bieten.
„So können wir nicht nur Monolagen an Enzymen einsetzen, sondern dies auch dreidimensional um ein Vielfaches erweitern, da die Elektronen im Gel an jeden Ort geleitet werden. Das sind gute Voraussetzungen für eine zukünftige Skalierung des Verfahrens für die chemische Industrie“, verdeutlicht Prof. Volker Sieber, der am Straubinger Institutsteil des Fraunhofer IGB schon lange Strategien zur CO2-Speicherung verfolgt.
Cofaktoren werden gleichzeitig permanent regeneriert
Der völlig neue Ansatz der Forschenden beruht aber nicht nur auf der Tatsache, dass eine enzymatische Reaktionssequenz erfolgreich mit Strom angetrieben werden kann, sondern beinhaltet auch ein weiteres äußerst innovatives Modul: Damit die Reaktionen wie gewünscht ablaufen und am Ende eine möglichst hohe Produktausbeute steht, braucht es in dem Fall eine kontinuierliche Zufuhr an „Doping“ fürs Enzym: die passenden und funktionalen Cofaktoren. Diese kleinen, organischen Moleküle werden im Lauf jeder einzelnen Reaktion verbraucht und müssen regeneriert werden, um wieder einsatzfähig zu sein. Sie in großen Mengen neu bereitzustellen, ist sehr teuer und damit für die Industrie unwirtschaftlich. Deshalb haben die eBioCO2n-Experten eine Möglichkeit gefunden, um sie mithilfe von Strom innerhalb des gleichen Reaktionssystems in den Hydrogelen wieder erneuern zu können – theoretisch unendlich lange. „Eigentlich müsste man nur ein einziges Mal Cofaktor ins System geben, und dieser würde dann immer wieder automatisch regeneriert. Aber in der Praxis funktioniert das nur annähernd so gut, weil der Cofaktor nicht unendlich lange stabil bleibt – aber durchaus schon sehr lange“, sagt Richter.
Für den bioelektrokatalytischen Recyclingprozess der Cofaktoren steht den Forschenden sogar ein ganzer Werkzeugkasten an unterschiedlichen Enzymen zur Verfügung, die sie aus verschiedenen Organismen aufgespürt haben. So ist das Spektrum dieser Biomoleküle für weitere Arbeiten je nach Anwendung modulartig erweiterbar und als Plattformsystem verwendbar.
„Man kann aus bioinformatischen Datenbanken praktisch beliebig Enzyme auswählen, diese biotechnologisch herstellen und in die Hydrogele einbauen“, sagt Richter. „So wäre die Herstellung verschiedener biobasierter Feinchemikalien denkbar, die man bei entsprechendem Ausbau über weitere Enzymkaskaden praktisch nach Bedarf diversifizieren könnte.“ Hier bringt inbesondere das Marburger MPI seine Expertise ein. Gelingt dies in einer entsprechenden Skalierung, könnte die Plattformtechnologie ein zukunftsträchtiges Geschäftsmodell für die chemische Industrie werden.
CO₂-Fixierung: Plattformsystem soll beliebig erweiter- und skalierbar werden
Mithilfe der bioinspirierten CO2-Fixierung aus dem Labor konnte man am Fraunhofer IGB ein Coenzym-A-Derivat carboxylieren, ein für viele Stoffwechselvorgänge in Lebewesen wichtiges Biomolekül.

Hierbei handelt es sich um das bislang anspruchsvollste Molekül, an das auf biokatalytischem Weg CO2 fixiert werden konnte. Das ist bei weitem nicht selbstverständlich, eine so große und strukturell anspruchsvolle Substanz mit dieser Technologie zu modifizieren.
Dr. Michael Richter, Leiter Innovationsfeld Bioinspirierte Chemie Fraunhofer IGB
Nun steht für die Forschenden die letzte Herausforderung an: zu beweisen, dass ihre Idee zuverlässig und skalierbar funktioniert sowie modular erweitert werden kann. Am IGB ist man jedoch optimistisch, vor allem auch vor dem Hintergrund eines gut funktionierenden interdisziplinären Teams, wie der Wissenschaftler betont. In Folgeprojekten sollen dann auch möglichst schnell Industriepartner mit einbezogen werden.
Publikation
Castañeda-Losada, Leonardo; Adam, David; Paczia, Nicole; Buesen, Darren; Steffler, Fabian; Sieber, Volker; Erb, Tobias; Richter, Michael; Plumeré, Nicolas.
Bioelectrocatalytic cofactor regeneration coupled to CO2 fixation in a redox-active hydrogel for stereoselective C-C bond formation.
in Angewandte Chemie. International edition 60 (2021), No.38, pp.21056-21061, DOI: 10.1002/anie.202103634